○橋本市民病院治験取扱規程
平成18年3月1日
病院事業管理規程第10号
(目的と適用範囲)
第1条 この規程は、橋本市民病院において臨床試験(以下「治験」という。)を実施するに当たり、医薬品の臨床試験の実施に関する基準(以下「GCP」という。)に従い、科学的に適正かつ倫理的な配慮のもとに治験が実施されるための事項を定めるものとする。
2 この規程は、医薬品の製造(輸入)承認又は承認事項一部変更承認申請の際に提出すべき資料の収集のために行う治験に対して適用する。
3 この規程に定める事項のほかは、GCPに準拠して別に定める治験にかかわる標準業務手順書による。
(治験審査委員会)
第2条 病院長は、治験を実施することの適否その他の治験に関する調査審議を行わせるため、橋本市民病院治験審査委員会(以下「治験審査委員会」という。)を設置する。
2 橋本市民病院治験審査委員会規程及び橋本市民病院治験審査委員会業務手順書は、別に定める。
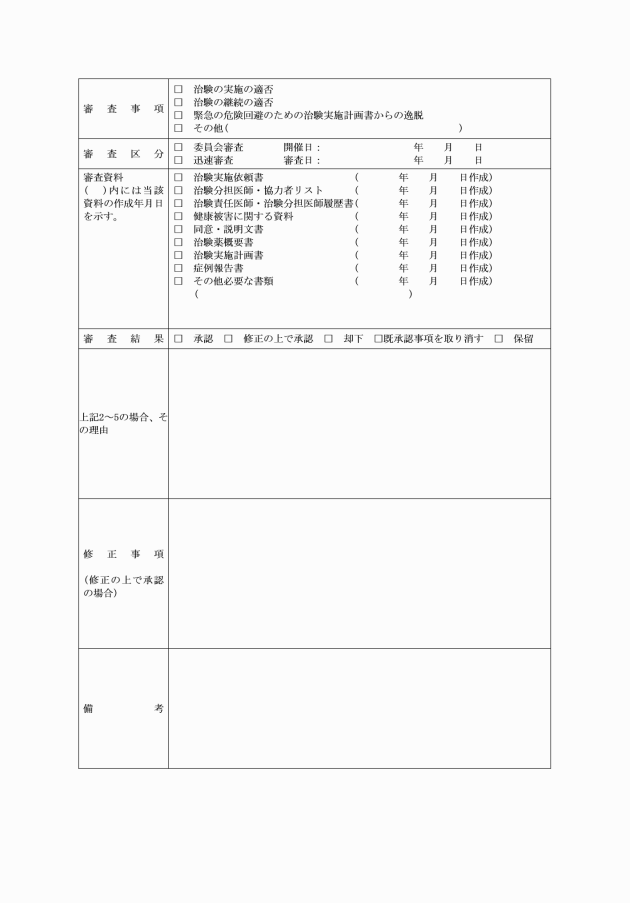
2 病院長は、審査に必要な資料を治験審査委員会に提出し、治験の実施について治験審査委員会の意見を求める。
(治験の承認)
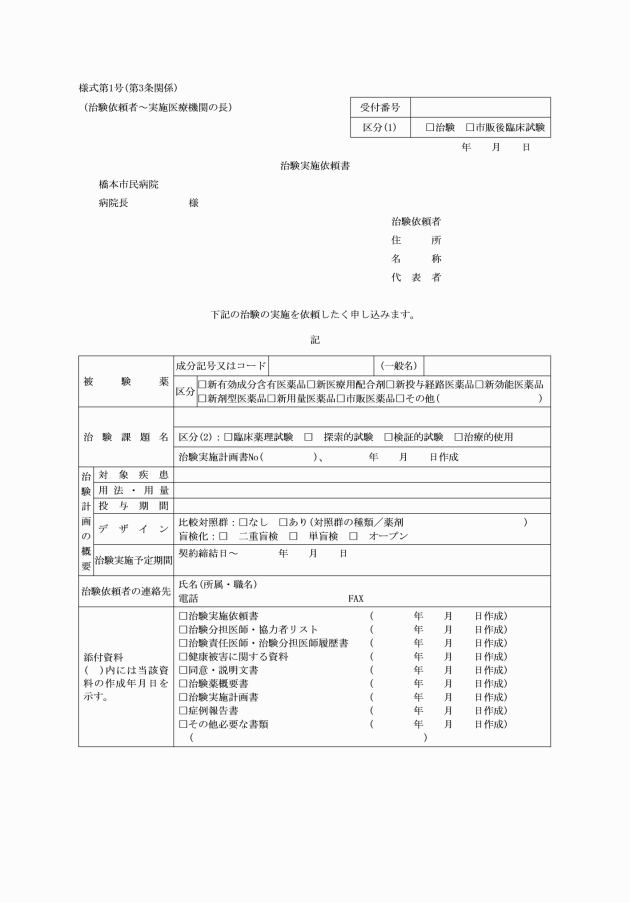
第4条 病院長は、治験審査委員会の報告に基づき、治験の実施又は変更の可否を決定し、治験依頼者及び治験責任医師等に治験に関する指示・決定通知書(様式第4号)により通知する。
(治験の契約)
第5条 病院長は、治験の承認を決定した後に治験依頼者と治験契約書(様式第5号)により契約を締結する。
(治験の実施)
第6条 治験責任医師等は治験計画に従い、適切な治験を実施しなければならない。
2 治験責任医師等は医療上やむを得ず治験計画書から逸脱した場合は、経過を記録し、直ちに病院長に報告しなければならない。
3 病院長は、逸脱の報告があった場合は治験依頼者にその旨を報告するとともに、治験審査委員会の意見を求め、指示・決定を治験に関する指示・決定通知書(様式第4号)により治験依頼者及び治験責任医師等に通知するものとする。
(副作用の報告)
第7条 治験責任医師等は、治験によると思われる死亡その他の重篤な有害事象が発生した場合は、直ちに病院長に報告しなければならない。
2 病院長は、重篤な有害事象発生の報告があった場合は、治験依頼者にその旨を報告するとともに、治験の継続について治験審査委員会の意見を求め、指示・決定を治験に関する指示・決定通知書(様式第4号)により治験依頼者及び治験責任医師等に通知するものとする。
(治験の中止、中断及び終了)
第8条 病院長は、治験依頼者が治験の中止若しくは中断又は被験薬の開発中止を決定し、その旨を開発の中止等に関する報告書(様式第6号)により通知してきた場合は、治験審査委員会及び治験責任医師等に速やかに通知するものとする。
2 病院長は、治験責任医師等が治験を中止又は中断し、その旨を治験終了(中止・中断)報告書(様式第7号)により報告してきた場合は、治験依頼者及び治験審査委員会に速やかに通知するものとする。
3 病院長は、治験責任医師等が治験の終了を報告してきた場合は、治験依頼者及び治験審査委員会に治験終了に関する通知書(様式第8号)により通知するものとする。
(治験責任医師等の責務)
第9条 治験責任医師等は、治験に関連する医療上のすべての判断に責任を負うものとする。
2 治験責任医師等は、治験の被験者を選定する場合には、人権擁護の立場から健康状態、症状、年齢、性別、同意能力、他の治験への参加の有無等、治験に参加を求める事の適否について慎重に検討しなければならない。
3 治験責任医師等は、被験者が治験に参加する前に被験者に対して、十分に説明し、治験への参加について自由意思による同意を治験参加同意書(様式第9号)により得るものとする。
(治験薬の管理)
第10条 治験薬の管理責任は、病院長が負うものとする。
2 病院長は、治験薬の適正な管理のため治験薬管理者を置き、薬剤部長をもってこの職務に充てる。ただし、病院長が認めた場合に限り、治験責任医師等を治験薬管理者とすることができる。
(治験事務局の設置)
第11条 病院長は、治験の実施に関する事務及び支援を行う者を指名し、治験事務局を設けるものとする。なお、治験事務局長は薬剤部長とする。
(記録の保存)
第12条 病院長は、橋本市民病院において治験に関する保存すべき必須文書の保存責任者を指名し、記録の保存を行う。なお、責任者は治験事務局長とする。
2 保存期間は、原則として以下のとおりとする。
(1) 当該被験薬に係る製造(輸入)承認日
(2) 治験の中止又は終了後3年が経過した日
(記録の閲覧)
第13条 病院長は、治験依頼者によるモニタリング及び監査並びに治験審査委員会及び国内外の規制当局による調査を受け入れるものとする。これらの場合には、モニター、監査当局者、治験審査委員会又は国内外の規制当局者の求めに応じ、現資料等のすべての治験関連記録を直接閲覧に供するものとする。
(補則)
第14条 この規程に定めるもののほか、必要な事項は、病院長が別に定める。
附則
(施行期日)
1 この規程は、平成18年3月1日から施行する。
(経過措置)
2 この規程の施行の日の前日までに、合併前の橋本病院治験取扱規程(平成16年橋本市病院事業管理規程第25号)の規定によりなされた処分、手続その他の行為は、この規程の相当規定によりなされたものとみなす。
附則(平成25年1月18日病管規程第3号)
この規程は、平成25年4月1日から施行する。
附則(令和3年8月2日病管規程第9号)
この規程は、公布の日から施行する。